



Biocontrol de Fusarium spp. en el cultivo de vainilla: Un nuevo modelo de estudio
Biocontrol against Fusarium spp. in vanilla crop: A new study model
Temas Agrarios
Universidad de Córdoba, Colombia
ISSN: 0122-7610
ISSN-e: 2389-9182
Periodicidad: Semestral
vol. 28, núm. 1, 2023
Recepción: 16 Febrero 2023
Aprobación: 21 Marzo 2023

Resumen: El control biológico es una opción potencial y sostenible para tratar las problemáticas de producción y rendimiento de cultivos afectados por insectos o microorganismos patógenos. En el cultivo de vainilla, la obtención del aroma natural presente en sus frutos está limitada, principalmente, por enfermedades bióticas que afectan la planta en cultivo comercial. La principal enfermedad presente el cultivo de vainilla es la pudrición de raíces y tallos, causada por F. oxysporum f. sp. radicis-vanillae . F. oxysporum f. sp. vanillae. En este sentido, se encontró que el uso de hongos endófitos (HE) aislados de plantas sanas o asintomáticas como potenciales agentes de control biológico, requiere una investigación sistemática para la selección de las especies más eficaces en el control de patógenos, en especial es este cultivo. Dado que no hay evidencia de reportes al respecto, a pesar de que el uso de estos microorganismos es una alternativa natural implementada en otros cultivos, frente a los agroquímicos contaminantes y ampliamente usados en la agricultura tradicional. De esta manera, esta revisión aborda la perspectiva y plantea la necesidad de líneas de investigación sobre el uso potencial de hongos endófitos como agentes de control biológico de patógenos fungosos en plantas cultivadas, haciendo énfasis sobre la relación Hongos endófitos-Vanilla- Fusarium patogénico.
Palabras clave: Fitoprotección, hongos patógenos, hongos endófitos, microbioma, orquídeas.
Abstract: Biological control is a potential and sustainable option to deal with crop production and yield problems affected by insects or pathogenic microorganisms. In vanilla crop, obtaining the natural scent present in its fruits is limited, mainly by diseases that affect commercial crops. The main disease of vanilla crop is root and stem rot (RSR), caused by F. oxysporum f. sp. radicis-vanillae and F. oxysporum f. sp. vanillae. We found that the use of endophytic fungi (EF) isolated from healthy or asymptomatic plants requires systematic research for the selection of the most effective species to control pathogens, particularly in this crop. Additionally, there is no evidence reported with respect to this topic, in spite of, the use of these microorganisms is a natural alternative in other crops, compared to the use of agrochemicals used in traditional agriculture. This review addresses the perspective, and raises the need for research on the potential use of endophytic fungi as biological control agents of fungal pathogens in cultivated plants, emphasizing the relationship Endophytic fungi-Vanilla-pathogenic Fusarium.
Keywords: Phytoprotection, pathogenic fungi, endophytic fungi, microbiome fungi orchids.
INTRODUCCIÓN
Una comprensión profunda del rol del microbiotapresenteen los sistemas naturales es esencial para valorar y potenciar las asociaciones entre los microorganismos y las comunidades vegetales (Sharma, 2022; Porras-Alfaro y Bayman, 2011). Esto es particularmente crítico en cultivos agrícolas, donde las prácticas de manejo si bien buscan incrementar el crecimiento y rendimiento de las plantas, también pueden afectar y crear condiciones ambientales propicias para la expresión y desarrollo de microorganismos patógenos. Tales condiciones, principalmente humedad, temperatura y disponibilidad de nutrientes, sumadas a los factores biológicos de las plantas hospederas, suelen reducir el rendimiento y resultan en importantes pérdidas económicas (Rojas et al., 2020a; De Silva et al., 2019; Hernández-Hernández, 2014).
Aunque el control biológico no es un concepto nuevo, ha crecido en importancia e interés de investigación en los últimos años (FAO, 2022). Esta es una técnica de manejo integrado de plagas y enfermedades (MIPE), la cual aborda soluciones naturales para el manejo de problemas fitosanitarios causados por microorganismos patógenos o insectos plaga. Para el control biológico de enfermedades de las plantas, el enfoque contempla el uso de microorganismos o sus metabolitos secundarios para la protección de cultivos (Sharma, 2022; Olantinwo et al., 2019; Sharma et al., 2018). Además, con la implementación del control biológico podría reducirse el uso de agroquímicos, los cuales a pesar de disminuir rápidamente la densidad poblacional del insecto plaga o el microorganismo patógeno, son altamente tóxicos y acumulativos en el medio ambiente (Sandheep et al., 2012; Alabouvette et al., 2009).
El uso de hongos endófitos (HE) como agentes de control biológico (ACB) o antagonistas tiene como objetivo prevenir enfermedades, reducir los síntomas causados por microorganismos patógenos y controlar la enfermedad antes o después de desarrollarse en las plantas (Sharma, 2022; De Silva et al., 2019; Card et al., 2016). Se ha demostrado a través de diferentes cultivos comerciales que el estudio y evaluación de hongos endófitos tiene un impacto positivo en la reducción de la incidencia y severidad de enfermedades. Algunos de estos cultivos incluyen el cacao - Theobroma cacao (Villavicencio-Vásquez et al., 2018; Villamizar-Gallardo et al., 2017; Arnold et al., 2003), camelia - Camellia oleífera (Yu et al., 2018) uchuva - Physalis peruviana (Manosalva y Mosquera- Espinosa, 2014), pepino - Cucumis sativus (Abro et al., 2019) y guaraguao - Guarea guidonia (Gamboa y Bayman, 2001).
En el cultivo de vainilla, el principal hongo patógeno es Fusarium oxysporum f. sp. radicis-vanillae (Forv), agente etiológico responsable de causar pudrición de raíces (Koyyappurath et al., 2015; Koyyappurath et al., 2016), y Fusarium oxysporum f. sp. vanillae (Fov), causando la pudrición de raíces y tallos (Kadir et al., 2021; Hernández- Hernández, 2019; Pinaria et al., 2015). Para controlar el progreso de estas enfermedades, se han utilizado varios métodos como la aplicación de fungicidas, aceites esenciales, y ACB reportados como hongos del género Trichoderma o bacterias del género Pseudomonas (Zhang et al., 2020). Sin embargo, ninguno de estos métodos ha sido suficiente para mejorar la productividad del cultivo. Por tal razón, esta revisión tiene como objetivo determinar mediante la búsqueda de artículos científicos los avances en el estudio de hongos endófitos como ACB en el cultivo de vainilla contra especies patogénicas de Fusarium, enfatizando en la investigación necesaria para llenar los vacíos de información y los desafíos actuales para tener éxito en la producción de esta orquídea.
MATERIALES Y MÉTODOS
Este documento consiste en una revisión de literatura, y provee información sobre ecología de hongos endófitos, su aislamiento y evaluación como agentes de control biológico en cultivos de interés agrícola y comercial, enfatizando la búsqueda en su uso en el cultivo de vainilla. De igual manera, se menciona la literatura relacionada a la interacción entre especies de Vanilla como hospedero y Fusarium con actividad patogénica según reportes de investigación.
La información consultada se tomó de diferentes artículos científicos, artículos de revisión y capítulos de libros disponibles en diferentes bases de datos bibliográficas como Scopus, ScienceDirect, Jstore, Web of Science, Wiley Online Library usando acceso con licencia de la Pontificia Universidad Javeriana (PUJ). También, se usaron los portales de búsqueda de libre acceso ResearchGate, Scielo, Mendeley y Google Scholar. Las palabras clave utilizadas en la búsqueda de literatura fueron “Biological Control”, “Biocontrol”, “Fungal Endophytes”, “Endophytic Fungi” “Fusarium”, “Vanilla”, “Orchids”. No se definió un periodo de tiempo la búsqueda de información, para poder identificar los avances en el conocimiento de este tema. La búsqueda de literatura se realizó tanto en inglés como en español.
RESULTADOS Y DISCUSIÓN
Cultivo de vainilla: Producción y desafíos
El producto natural de la vainilla es utilizado predominantemente en gastronomía, cosmética, perfumería y farmacología (Olatunde et al., 2022; Grisoni y Nany, 2021; Ahmad et al., 2020; Flanagan y Mosquera- Espinosa, 2016). Esto se debe al componente vainillina presente en los frutos de las especies comerciales Vanilla planifolia y el híbrido V. x. tahitensis, cultivados en diferentes países tropicales, incluidos Madagascar, Indonesia, México y China, principales productores y exportadores de este producto (FAO, 2022).
La mayor parte del producto o esencia de vainilla comercializados actualmente es de origen artificial, por lo cual, existe interés en volver al extracto natural. Sin embargo, el fruto de las plantas de vainilla debe desarrollarse para obtener este producto final, lo que trae otro desafío. La producción de frutos en especies aromáticas de vainilla está limitada por la floración poco frecuente y la baja abundancia de polinizadores naturales, llevando a que la vainilla natural sea costosa al ser requerido un proceso de polinización manual (Grisoni y Nany, 2021; Romero-Cortes et al., 2019; Ordoñez et al., 2012; Soto-Arenas, 2004).
Así mismo, el uso generalizado de la propagación vegetativa por esquejes ha llevado a una baja variabilidad genética de los cultivos aumentando así la vulnerabilidad a patógenos o insectos plaga, y a cambios bruscos de temperatura, pH del suelo o humedad (Montes de Oca-Vásquez et al., 2020; Ordoñez et al., 2012; Soto-Arenas, 2004). En particular, se ha demostrado que la baja diversidad genética y las altas temperaturas (superior a 30°C) están relacionadas con el aborto prematuro de los frutos en V. planifolia (Borbolla-Pérez et al., 2016). Además, las condiciones de temperatura y humedad ambiental y del suelo requeridos por el cultivo de vainilla favorecen el desarrollo de microorganismos patógenos (Hernández-Hernández, 2019; Hernández et al., 2018; Ramos-Quintana et al., 2017).
A pesar del aumento en el área de extensión del cultivo de vainilla en los últimos años, se ha disminuido la producción y el rendimiento de los mismos (Figura 1). Lo anterior, podría ser explicado por el aumento de la incidencia de enfermedades al transcurrir de los años de siembra continua, disminuyendo a su vez la producción de los cultivos de vainilla (Xiong et al., 2016; Xiong et al., 2015; Zhao et al., 2012). Para esto, algunos autores sugieren que la vainilla en monocultivo debe durar menos de 10 años, y así evitar pérdidas significativas en su producción (Xiong et al., 2017; Xiong et al., 2015); teniendo en cuenta que, con el paso del tiempo, las características físicas, químicas y biológicas de los suelos también cambian (Li y Liu, 2019).
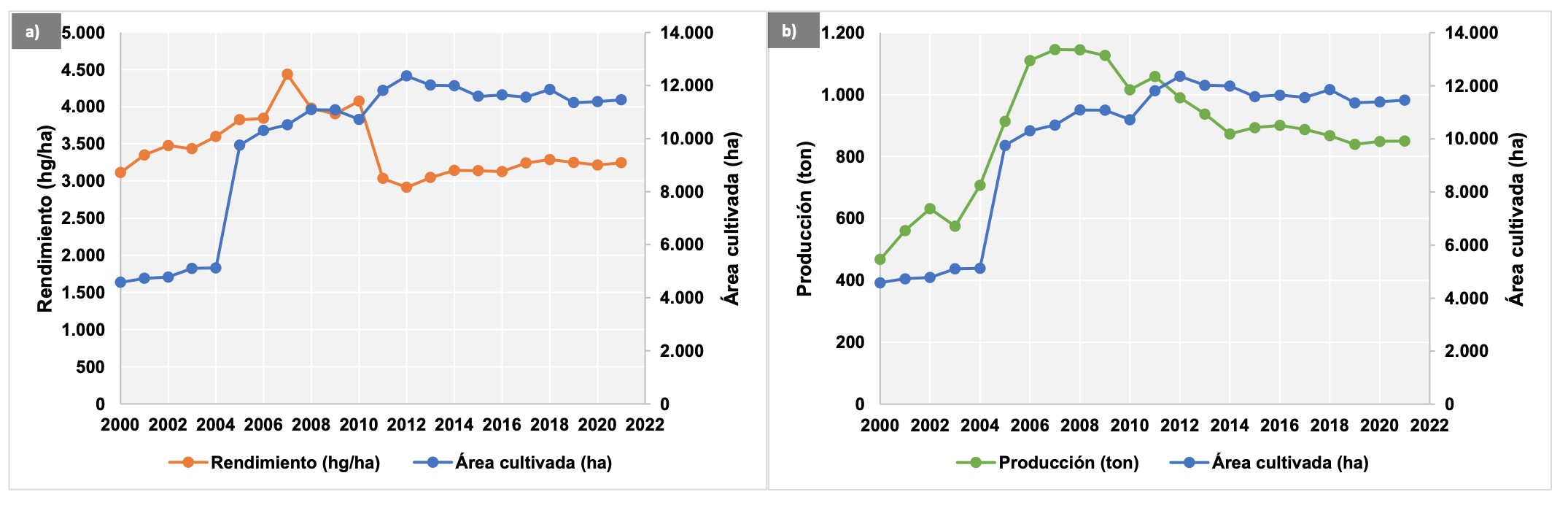
En los cultivos de vainilla, la principal enfermedad se identifica de forma generalizada como una pudrición de raíces y tallos – RSR, Root and Stem Rot y es causada por especies patogénicas del hongo Fusarium oxysporum (Flores-de la Rosa et al., 2018; Adame-García et al., 2015a; Koyyappurath et al., 2015; Marín- Montoya et al., 2012; Pinaria et al., 2010). Esta enfermedad registra pérdidas en los cultivos de vainilla de hasta un 80% en Indonesia (Pinaria et al., 2010), hasta un 67% en México (Hernández-Hernández, 2014) y un 40-50% en Puerto Rico (Bayman, 2019).
Interacciones de los Hongos endófitos Los microorganismos son clasificados con base en diferentes criterios y dentro de los hongos asociados a las plantas se identifican cinco grupos funcionales o roles ecológicos: micorrízicos, patógenos, saprofitos, epífitos y endófitos. Estos últimos, los hongos endófitos (HE), representan un grupo de microorganismos de alta riqueza en especies y diversidad ecológica los cuales coexisten y se superponen en funciones con uno o más de los otros grupos funcionales a lo largo de su ciclo de vida, actuando principalmente en respuesta a las señales de su hospedero (Wu et al., 2020; De Silva et al., 2019; Rather et al., 2018; Scott et al., 2018; Card et al., 2016). A su vez, las señales del hospedero varían de acuerdo a los cambios ambientales ocasionados por factores bióticos o abióticos, lo que explica el cambio de actividad de este grupo de microorganismos (HE) (Li et al., 2020a; Zhang et al., 2019; Porras-Alfaro y Bayman, 2011, Rodriguez et al., 2009).
El término “endófitos” fue acuñado por Anton de Bary en 1886 (Wilson, 1995), para referirse a microorganismos, comúnmente hongos y bacterias, que pasan parte o todo su ciclo de vida dentro de los tejidos vegetales, definiendo la ubicación del microorganismo en su hospedero, más que una relación funcional con el mismo (Zhang et al., 2019; Novotná et al., 2018; Porras-Alfaro y Bayman, 2011). Con el tiempo la definición se amplió, a los microorganismos que viven dentro del tejido de un hospedero sin causar ningún síntoma, pues estos microorganismos no cumplen una función específica, ya que podrían actuar de forma neutra, beneficiosa o perjudicial en su hospedero (Zhang et al., 2019; De Silva et al., 2019; Scott et al., 2018; Porras-Alfaro y Bayman, 2011; Wilson, 1995).
Los hongos endófitos se reportan como patógenos latentes o saprofitos, ya que podrían desarrollarse en detrimento de su hospedero, actuando en cualquiera de estos dos roles; ya sea en respuesta a factores ambientales o a la disminución en la expresión de genes de resistencia de sus hospederos (Alomía et al., 2022; Zhang et al., 2019; Porras-Alfaro y Bayman, 2011). Algunos hongos endófitos son patógenos o están relacionados filogenéticamente con otros hongos comúnmente reportados como patógenos. Por ejemplo, hongos de los géneros Colletotrichum, Xylaria . Fusarium (Teleomorfo: Nectria) han sido reportados como endófitos en Theobroma cacao (Arnold et al., 2003), Zanthoxylum oxyphyllum (Talukdar y Tayung, 2021), Sorghum bicolor (Silva et al., 2023). Pero en cultivos de cereales, tomate, algodón, pepino y orquídeas, también se reportan especies de Fusarium. Colletotrichum como patógenos de importancia comercial (Soleha et al., 2022; Rojas et al., 2020a; Abro et al., 2019; Sarsaiya et al., 2019; Srivastava et al., 2018). En contraste, especies de Xylaria también se reportan con función benéfica como hongos micorrízicos de orquídeas de Oeceoclades maculata (Bayman et al., 2016).
Hongos endófitos como agentes de biocontrol (ACB)
Cuando se utilizan microorganismos como agentes de control biológico, el objetivo es reducir el inóculo del agente patógeno y evitar una mayor diseminación. Así, los hongos endófitos detendrían parcial o totalmente el ciclo de la enfermedad, controlando o modificando el desarrollo de los hongos fitopatógenos (Sharma, 2022; De Almeida et al., 2020; De Silva et al., 2019; Porras-Alfaro Bayman, 2011; Arnold et al., 2003).
Si bien se encuentra una amplia diversidad de hongos endófitos en los tejidos vegetales (Barolo et al., 2023; Alomía et al., 2022; Wu et al., 2020; Rojas et al., 2020; Novotná et al., 2018; Scott et al., 2018; Arnold et al., 2003), no todos tendrán potencial como agentes de biocontrol. Para evaluar el potencial biocontrol de estos microorganismos, se parte de la selección del material vegetal, aislamiento e identificación de los hongos endófitos, y posteriormente se realizan ensayos in vitro, los cuales se basan principalmente en cultivos duales (Figura 2) (Peters et al., 2020; Villavicencio- Vásquez et al., 2018; Manosalva y Mosquera- Espinosa, 2014). Los mecanismos evaluados directamente en los cultivos duales son la competencia por espacio y nutrientes entre el ACB y el patógeno, así como la fungistasis y secreción de metabolitos secundarios (Shahrtash y Brown, 2023; Nguyen et al., 2020; Latz et al., 2018; Talapatra et al., 2017; Suryanarayanan et al., 2016). Estos metabolitos actúan como sustancias antifúngicas y antibacterianas, y tienen una función determinante en el mantenimiento del equilibrio de antagonismos entre endófitos, patógenos y plantas hospederas (Adeleke et al., 2022; Huang et al., 2020; Villamizar- Gallardo et al., 2017).
Una vez identificados los aislamientos fúngicos prometedores en los ensayos in vitro, se procede con los ensayos de biocontrol in vivo (en la planta focal) (Figura 2). Aquí se evalúa la reducción de la sintomatología causada por el patógeno sobre el hospedero al aplicar el potencial ACB (Peters et al., 2020). Una reducción de los síntomas en comparación con el control absoluto, indica que el tratamiento con HE tiene efecto directo sobre la actividad y biomasa del hongo patógeno (Rojas et al., 2020b). Sin embargo, al no haber evidencia tangible o visualización macroscópica de los mecanismos involucrados, como la antibiosis o la competencia, se interpreta como el mecanismo más probablemente involucrado la inducción de resistencia sistémica, es decir a la activación de los mecanismos de defensa propios de la planta mediante la liberación de hormonas (De Silva et al., 2019; Latz et al., 2018; Mosquera-Espinosa et al., 2013).
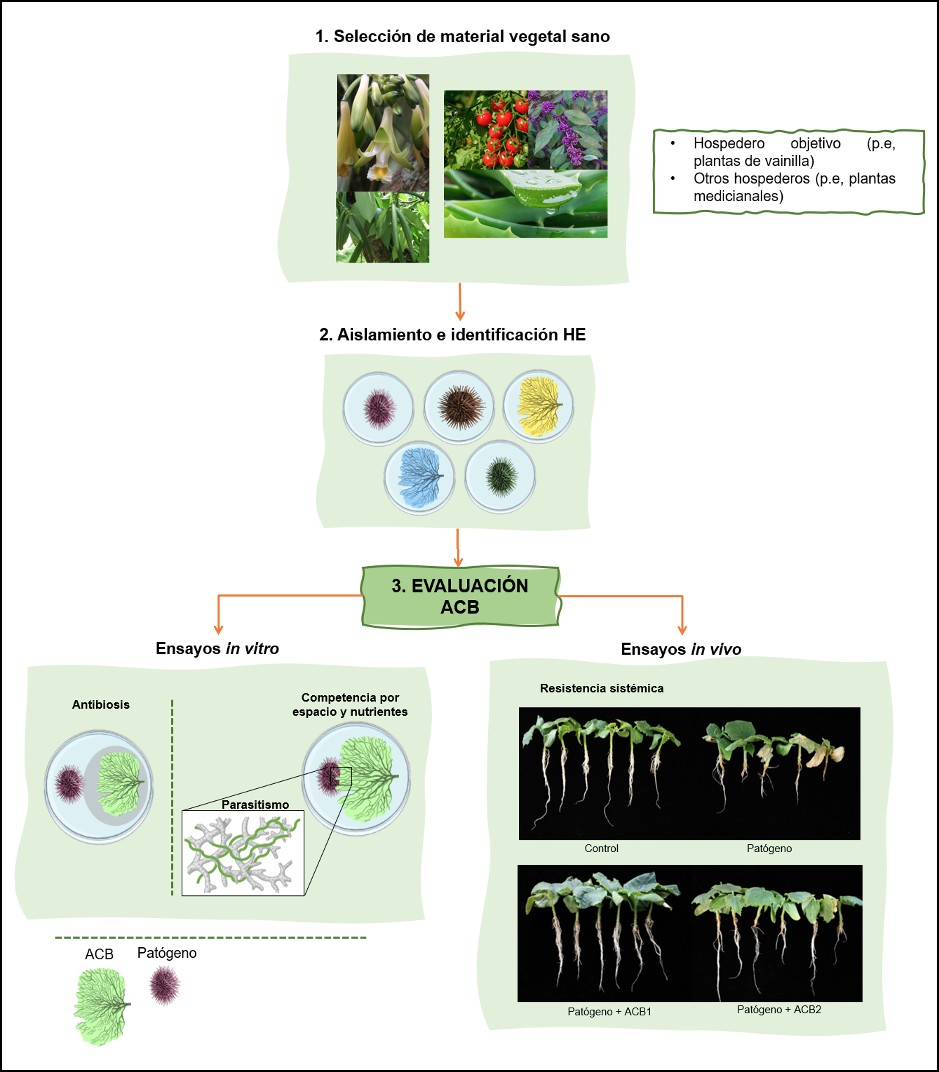
Figura 2. Ruta investigativa en la selección y evaluación in vitro . in vivo de potenciales ACB; se muestran los mecanismos de biocontrol que se pueden evaluar en cada ensayo. (Franco-Galindo, L)
Hongos endófitos como ACB de Fusarium spp. en otros cultivos
La incidencia de enfermedades causadas por especies del género Fusarium va en aumento, siendo F. oxysporum la especie de mayor importancia económica, a causa de las devastadoras consecuencias de su expresión en los sistemas de producción agrícola del mundo. La erradicación de este patógeno es compleja y los métodos de control limitados, debido a su amplia distribución y sobrevivencia prolongada en el suelo (Muche y Yemata, 2022; Ratankumar et al., 2022; Soleha et al., 2022; Ge et al., 2021; Srivastava et al., 2018).
Siendo los HE una estrategia promisoria frente al uso de fungicidas y fertilizantes químicos, así como una opción que se encuentra dentro del mismo sistema natural, es posible encontrar casos de estudio donde estos microorganismos muestran resultados satisfactorios contra la fusariosis. Hongos endófitos como Botryosphaeria quercum muestra hasta un 80% de actividad biocontroladora sobre patógenos de Theobroma cacao, respecto a la acción de hongos micoparásitos ampliamente usados como Trichoderma spp. (Villamizar-Gallardo et al., 2017).
En cultivos de plátano, Penicillium citrinum se reporta como endófito con capacidad de inducir resistencia en el hospedero contra F. oxysporum f.sp. cubense (Foc), el agente causal de la enfermedad conocida como Mal de Panamá o Fusarium Wilt of Banana (FWB) (Yang et al., 2022; Ting et al., 2012). Además, el tratamiento con el endófito Trichodermaatroviride mostró diferencias significativas en la reducción de la sintomatología interna de las plantas de plátano, como la decoloración del cormo (tejido vascular de la planta) (Ortiz y Pocasangre, 2012). La investigación también aborda el papel e importancia de los compuestos volátiles producidos por hongos endófitos como Penicillium spp. o Cladosporium spp. como mecanismo de antagonismo contra este patógeno en el cultivo de plátano (Ting et al., 2010). Incluso, se reporta la presencia de compuestos antifúngicos producidos por Acremoniumsp. aislado de garbanzo (Cicer arietinum) (Chowdhary y Kaushik, 2018).
Otras especies del género como F. graminearum endófito aislado de uchuva (Physalis peruviana), ha mostrado actividad biocontroladora sobre el patógeno F. verticillioides en condiciones in vitro (Manosalva y Mosquera-Espinosa, 2014). En tanto, F. equiseti redujo entre un 40% y 90% la severidad de la enfermedad causada por F. oxysporum f. sp. spinaciae en espinaca (Spinacia oleracea), disminuyendo la producción de nuevas conidias del patógeno (Horinouchi et al., 2010). Como evidencia de la plasticidad funcional de los hongos se han registrado especies no patogénicas de F. oxysporum (npFo) con capacidad de reducir la incidencia y severidad de enfermedades de origen fungoso, haciendo de estos aislamientos potenciales agentes de control biológico; sin embargo, su selección requiere mayor cuidado al existir la posibilidad de que promuevan un mayor desarrollo de la enfermedad (Li et al., 2020b; Forsyth et al., 2006).
Igualmente, el uso de hongos endófitos aislados de plantas medicinales, como el narciso (Narcissus pseudonarcissus), pino (Pinus massoniana) o áloe (Aloe dhufarensis) se ha realizado por el valor antimicrobiano que muchas de estas plantas poseen, más no por actividad de sus HE (Al- Rashdi et al., 2020; Xiang et al., 2019). Abro et al. (2019) exploraron el potencial como ACB de hongos endófitos, usaron aislamientos de estos microorganismos provenientes de tomate (Lycopersicon esculentum), anís (Illiciumverum), mangle (Rhizophora mangle) y el árbol de Aquilaria (Aquilaria sinensis), basándose en reportes del valor de los compuestos bioactivos que estas plantas producen. Los resultados de estos aislamientos fueron positivos, en condiciones in vitro al inhibir el crecimiento micelial de Fusarium oxysporum f. sp. cucumerinum, e in vivo al reducir significativamente los síntomas causados en plantas de pepino, y al influir en el crecimiento y aumento de biomasa de estas.
Rojas et al. (2020) realizaron un proceso de selección de hongos endófitos de trigo como potenciales agentes de control biológico contra F. graminearum. Ellos indican que, al hacer una selección por medio de cultivos duales, los organismos prometedores de su estudio habrían sido descartados, al no encontrar una correlación directa entre la inhibición del crecimiento del patógeno, por medio de esta técnica, y la reducción de los síntomas de la enfermedad en las plantas evaluadas. Recomendando así, la implementación de métodos de selección in vivo (in planta) que permitan mejor reproducibilidad de las condiciones naturales a las que se ven enfrentados los microorganismos. Además, muestran la relevancia de los tiempos de inoculación de los hongos endófitos en la efectividad de la reducción de síntomas, al permitir el establecimiento de este antes que el patógeno (Horinouchi et al., 2010; Mosquera-Espinosa et al., 2013).
Control biológico de Fusarium oxysporum en cultivos de vainilla
En los cultivos de vainilla comercial, para controlar el desarrollo de la pudrición de raíces y tallos (RSR), los fungicidas comúnmente utilizados son carbendazim y mezcla de Burdeos (Bouillie Bordelaise) (Hernández-Hernández, 2014). Sin embargo, para reducir el uso de estas sustancias también se implementan prácticas agronómicas como el manejo de un buen drenaje del suelo y un mayor flujo de aire, o estableciendo distancias de siembra adecuadas entre plantas para evitar el exceso de luz solar y sombra, entre otros factores (Hernández-Hernández, 2019). Para el manejo de Forv y Fov en el cultivo de vainilla, también se han utilizado aceites esenciales como los aceites de canela, tomillo y clavo (Hernández- Hernández, 2014). Aunque el efecto de los aceites esenciales contra patógenos es hasta de un 60% en la reducción de la incidencia de enfermedades, debido principalmente a su carácter volátil, su uso en campo podría conducir a una baja persistencia de su efecto en el tiempo, lo que hace perder su efectividad (Eke et al., 2020; Barrera-Necha y García-Barrera, 2008).
Para el control biológico de F. oxysporum f. sp. vanillae en el cultivo de vainilla, se han evaluado diversos microorganismos como potenciales ACB, incluyendo hongos y bacterias rizosféricas, además de bacterias endófitas (Tabla 1). En estos estudios se evalúan antagonistas reportados con éxito en la literatura contra el hongo fitopatógeno F. oxysporum f. sp. vanillae. Trichoderma rizosférico mostró porcentaje de inhibición del crecimiento del patógeno del 50% al 80% en condiciones in vitro. Además, se aislaron las enzimas quitinolíticas producidas por Trichoderma y se evaluó la actividad antagónica de las mismas, demostrando así que la actividad de las enzimas sobre un sustrato de quitina no era significativa (alrededor del 30%). Sin embargo, la actividad enzimática de las cepas de Trichoderma aumentaba cuando esta se encontraba en presencia de quitina respecto al control, lo que respalda la actividad antagonista de Trichoderma, destacando su potencial como ACB de patógenos de vainilla (Radjacommare et al., 2014). Incluso, se concluye que la acción integrada de Trichoderma . Pseudomonas, junto con sus metabolitos podría mejorar su actividad de biocontrol contra Fov en vainilla (Sandheep et al., 2012; Jayasekhar., 2008).
Tabla 1. Mecanismos de antagonismo evaluados contra de F. oxysporum f. sp. vanillae (Fov) en especies de Vanilla.
| Microorganismo | Agente de control biológico | Mecanismo evaluado | Referencia |
| Bacterias | StaphylococcusxylosusSerratia sp. Stenotrophomonas sp. Pseudomonas sp. | Competencia por espacio y nutrientes | Adame-García et al. (2015b) |
| CepabacterianaB1M11 | Antibiosis | Jiménez-Quesada et al., 2015 | |
| Bacillusamyloliquefaciens | Antibiosis | White et al., 2014 | |
| Hongos y bacterias rizosféricos | TrichodermaharzianumPaecilomyces sp. Pseudomonasfluorescens | Competencia por espacio y nutrientes Resistencia sistémica | Bhai et al., 2009 |
| TrichodermaharzianumPseudomonasfluorescensBacillus subtilis | Competencia por espacio y nutrientes Antibiosis | Gangadara et al., 2010 | |
| TrichodermaharzianumPseudomonasfluorescens | Competencia por espacio y nutrientes Antibiosis | Jayasekhar et al., 2008 | |
| Trichoderma sp. Pseudomonasfluorescens | Parasitismo Competencia por espacio y nutrientes | Radjacommare et al., 2010 | |
| Trichoderma harzianumPseudomonasfluorescens | Competencia por espacio y nutrientes | Sandheep et al., 2012 |
Bhai et al. (2009) reportaron a Paecilomyces aislado de la rizosfera como un potencial agente de control biológico de la pudrición de raíces y tallos en vainilla, al presentar de un 65% a 100% de inhibición de patógenos en ensayos in vitro tanto en laboratorio como en invernadero, respectivamente. También se ha reportado a Bacillus subtilis como otro antagonista bacteriano que controla a Fov en condiciones in vitro (Gangadara et al., 2010). White et al. (2014) evaluaron a Bacillus amyloliquefaciens como una bacteria endófita sistémica de plantas de vainilla, que promueve el crecimiento de las plántulas y produce inhibidores de hongos en cultivo contra fitopatógenos, incluidos F. oxysporum, Colletotrichum dematium, Lasiodiplodia theobromae . Alternaria alternata, por lo cual esta bacteria puede ser usada para alterar comunidades microbianas en suelo rizosférico (Wu et al., 2019).
Adame-García et al. (2015b) demostraron que las rizobacterias asociadas con V. planifolia, incluidas Staphylococcus, Serratia y Stenotrophomonas, tienen capacidad antagonista contra Fov en condiciones in vitro sin presencia de la planta. Pero en la evaluación en invernadero, los tratamientos indujeron en el hospedero síntomas de clorosis, pudrición de tejidos e incluso la muerte de esquejes. Finalmente, los autores demostraron que no existe una correlación positiva entre el antagonismo expresado en condiciones de laboratorio y el expresado en condiciones de invernadero. Además, la selección de plantas de V. planifolia resistentes a Fov ha sido un estudio biotecnológico prometedor, en el que alrededor del 27% de las plantas supervivientes mostraron resistencia a Fov después de pruebas in vitro y en condiciones de campo (Ramírez-Mosqueda et al., 2015; 2018; 2019).
Por último, cabe resaltar que no fue evidenciado en la literatura evaluaciones sobre el uso de hongos endófitos como potenciales ACB en cultivos de vainilla, a pesar que ya se han aislado y reportado estos microorganismos de plantas de vainilla en solo 2 investigaciones (Tabla 2). De esta manera, es posible justificar el planteamiento de la relación hongos endófitos Vanilla- Fusarium patogénico en Colombia y el mundo, como un modelo de estudio promisorio. Por otro lado, los hongos endófitos de Vanilla aparentemente juegan un papel destacado en la protección de la planta y en el desarrollo de las propiedades organolépticas del fruto (Khoyratty et al., 2015); y al colonizar el tejido radical, podrían participar, hasta cierto punto, en la transferencia de nutrientes a la planta promoviendo su crecimiento (Carbajal- Valenzuela et al., 2022; Romero-Cortes et al., 2019; Murphy et al., 2018; Scott et al., 2018; Flanagan y Mosquera-Espinosa, 2016; Khoyratty et al., 2015; Ordoñez et al., 2012).
Tabla 2. Hongos endófitos aislados de Vanilla planifolia
| Fillum | Clase | Orden | Hongo endófito* | Origen geográfico | Referencia |
| Ascomycota | Dothideomycetes | Botryosphaeriales | Botryosphaeriaribis | St. Anne, Réunion Island | Khoyratty et al. 2015 |
| Guignardiamangiferae | St. André, Réunion Island | Khoyratty et al. 2015 | |||
| Capnodiales | Mycosphaerellamarksii | St. André, Réunion Island | Khoyratty et al. 2015 | ||
| Pleosporales | Bipolarissp. | Sucre, Colombia | Ordoñez et al. 2012 | ||
| Delitschiachaetomioides | St. André, Réunion Island | Khoyratty et al. 2015 |
| Phoma sp. | Antioquia, Colombia | Ordoñez et al. 2012 | |||
| Eurotiomycetes | Eurotiales | Aspergillus fumigatus | Mare Longue, Réunion Island | Khoyratty et al. 2015 | |
| Penicillium citrinum | Mare Longue, Réunion Island | Khoyratty et al. 2015 | |||
| Pezizomycetes | Pezizales | Sarcosomata- ceae spp. | St. André, Réunion Island | Khoyratty et al. 2015 | |
| Sordariomycetes | Diaporthales | D i a p o r t h e phaseolorum | St. Anne, Réunion Island | Khoyratty et al. 2015 | |
| Phomopsis phyllanthicola | Mare Longue, Réunion Island | Khoyratty et al. 2015 | |||
| Phomopsis sp. | Antioquia, Colombia | Ordoñez et al. 2012 | |||
| Glomerellaceae | Colletotrichum gloesporioides | St. Anne, Réunion Island | Khoyratty et al. 2015 | ||
| Hypocreales | Acremonium implicatum | St. Rose, Réunion Island | Khoyratty et al. 2015 | ||
| Fusarium oxysporum | St. Anne, Réunion Island | Khoyratty et al. 2015 | |||
| Fusarium proliferatum | St. André, Réunion Island | Khoyratty et al. 2015 | |||
| Fusarium scirpi | St. André, Réunion Island | Khoyratty et al. 2015 | |||
| Purpureocillium lilacinum | St. Anne, Réunion Island | Khoyratty et al. 2015 | |||
| Trichoderma sp. | Sucre, Colombia | Ordoñez et al. 2012 | |||
| Trichosphaeriales | Nigrospora sp. | St. André, Réunion Island | Khoyratty et al. 2015 | ||
| Xylariales | Hypoxylon sp. | Sucre, Colombia | Ordoñez et al. 2012 | ||
| Nemania bipapillata | St. Rose, Réunion Island | Khoyratty et al. 2015 | |||
| Pestalotiopsismicrospora | St. Rose, Réunion Island | Khoyratty et al. 2015 | |||
| Xylaria sp. | Antioquia, Colombia | Ordoñez et al. 2012 | |||
| Xylaria sp. | St. André, Réunion Island | Khoyratty et al. 2015 | |||
| Basidiomycota | Agaricomycetes | Polyporales | Perenniporia nanlingensis | St. André, Réunion Island | Khoyratty et al. 2015 |
| Zygomycetes | Mucorales | Cunninghamella blakesleana | T akamaka, Réunion Island | Khoyratty et al. 2015 |
CONCLUSIONES
Los hongos endófitos (HE) como agentes de control biológico (ACB) tienen el potencial de ejercer actividad antagónica sobre hongos patógenos en cultivos agrícolas. Así mismo, la interacción HE-Vanilla-Fusarium (ACB- Planta-Patógeno) es un sistema de estudio prometedor para identificar hongos endófitos con potencial biocontrolador sobre especies patogénicas del género Fusarium en cultivos de vainilla. Lo anterior, permitiría evitar o reducir la incidencia de la pudrición de raíces y tallos en estas plantas, principal limitante fitosanitaria para la producción de frutos. El montaje de los experimentos es relativamente sencillo, sin embargo, interpretar la interacción de los tres factores bióticos que participan es complejo, más aún, cuando se desconoce la respuesta funcional de los hongos endófitos. Esta realidad pone en evidencia, el vacío de información científica publicada sobre la evaluación de hongos endófitos de vainilla como ACB de F. oxysporum f. sp. radicis-vanillae y/o de F. oxysporum f. sp. vanillae, por ende, la relevancia de los estudios reportados sobre el biocontrol de Fusarium con hongos endófitos en otros cultivos como modelos de estudio.
Si bien el cultivo de vainilla es un cultivo de alto interés comercial, hay muy poca investigación con resultados puestos en práctica para su sostenibilidad. Además, dada la susceptibilidad de los cultivos de vainilla a especies patogénicas de Fusarium y las desventajas de los fungicidas químicos para su manejo, se torna urgente la necesidad de evaluar métodos de control biológico in situ que puedan contribuir a incrementar la productividad en estos cultivos. Es por ello que, también se debe considerar el aporte del control genético de las poblaciones de parientes silvestres de las especies aromáticas de Vanilla en el mundo, ya que podrían representar una importante riqueza de genes en el material natural, así como una gran fuente de microorganismos endófitos y sus metabolitos secundarios, elementos no valorados para proponer dentro del manejo integrado de problemas fitosanitarios.
REFERENCIAS
Abro, M., Sun, X., Li, X., Jatoi, G. y Guo, L. 2019. Biocontrol Potential of Fungal Endophytes against Fusarium oxysporum f. sp. cucumerinum causing Wilt in Cucumber. Plant Pathol. J. 35(6), 598-608. https://doi.org/10.5423/PPJ.OA.05.2019.0129
Adame-García, J., Rodríguez, G, Iglesias, A., Ramos, P. y Luna, R. 2015a. Molecular identification and pathogenic variation of Fusarium species isolated from Vanilla planifolia in Papantla Mexico. Bot. Sci. 93, 669–678. https://doi.org/10.17129/bots-ci.142
Adame-García, J., Luna-Rodríguez, M. y Iglesias-Andreu, L. 2015b. Vanilla Rhizobacteria as Antagonists against Fusarium oxysporum f. sp. vanillae. Int. J. Agric. Biol., 18(1). https://doi.org/10.17957/IJAB/15.0053
Adeleke, B., Ayilara, M., Akinola, S. y Babalola, O. 2022. Biocontrol Mechanisms of endophytic fungi. Egyptian Journal of Biological Pest Control. 32:46. https://doi.org/10.1186/s41938-022-00547-1
Ahmad, H., Ahmad, R., Asif, M., Adnan, M. y Idrees, M. 2020. Vanilla. In: Asif, M., Nawaz, H., Mumtaz, M., Byrne, M., (Eds.) Medicinal Plants of South Asia. Elsevier. 657-669. ISBN 9780081026595. https://doi.org/10.1016/B978-0-08-102659-5.00048-3
Alabouvette, C., Olivain, C., Migheli, Q. y Steinberg, C. 2009. Microbiological control of soil-borne phytopathogenic fungi with special emphasis on wilt-inducing Fusarium oxysporum. New Phytol. 184, 529-544. https://doi.org/10.1111/j.1469-8137.2009.03014.x
Alomía, Y., Tupac-Otero, J. y Jersáková, J., Stevenson, P. 2022. Cultivable fungal community associated with the tropical orchid Dichaea andina. Fugal Ecol. 57- 58:101158. https://doi.org/10.1016/j.funeco.2022.101158
Arnold, E., Mejía, L., Kyllo D., Rojas, E., Maynard, Z., Robbins, N. y Herre, E. 2003. Fungal Endophytes limit pathogen damage in a tropical tree. PNAS. 100(26), 15649-15654.
Barolo, M., Castelli, M. y López, S. 2023. Antimicrobial properties and biotransformating ability of fungal endophytes from Ficus carica L. (Moraceae). Mycology. 1-24. https://doi.org/10.1080/21501203.2023.217550
Barrera-Necha, L. y García-Barrera, L. 2008. Antifungal activity of essential oils and their compounds on the growth of Fusarium sp. Isolate from papaya (Carica papaya). Rev. UDO. Agric. 8(1), 33-41. https://dialnet.unirioja.es/servlet/articulo?codigo=3094829
Bayman, P., Mosquera-Espinosa, A., Saladini-Aponte, C., Hurtado-Guevara, N. y Viera-Ruiz, N. 2016. Agede pendent mycorrhizal specificity in an invasive orchid, Oeceoclades macu- lata. Am. J. Bot. 103(11). 1880-1889. https://doi.org/10.3732/ajb.1600127
Bayman, P. 2019. The History of Vanilla in Puerto Rico: Diversity, Rise, Fall, and Future Prospects. In: Havkin-Frenkel, D., Belanger, F. (Eds.) Handbook of Vanilla Science and Technology, 2nd Edition. Wiley Blackwell. pp. 111-118
Bhai, R. y Dhanesh, J. 2008. Occurrence of fungal diseases in vanilla (Vanilla planifolia Andrews) in Kerala. J. Spices. Aromat. Crops. 17: 140–148. https://updatepublishing.com/journal/index.php/josac/article/view/4907
Bhai, S., Remya, B., Danesh, J. y Eapen, S. 2009. In vitro and in planta assays for biological control of Fusarium root rot disease of Vanilla. J. Biol. Control. 23(1), 83-86. https://doi.org/10.18311/JBC/2009/3621
Bordolla-Pérez, V., Iglesias-Andreu, L., Herrera-Cabrera, B. y Vovides-Papalouka, A. 2016. Aborción prematura de frutos de Vanilla planifolia Jack. Ex Andrews. Agro- Productividad. 9(S1). https://revista-agro-productividad.org/index.php/agroproducti-vidad/article/view/873
Casillas-Isiordia, R., Flores-de la Rosa, F., Can-Chulim, A., Luna, E., Rodríguez-Guerra, R., Ramírez-Guerrero, L. y Luna-Rodríguez, M. 2017. Fusarium sp. associated with Vanilla sp. rot in Nayarit, Mexico. ARPN J. Agric. Biol. Sci. 12(2), 43-50. http://dspace.uan.mx:8080/jspui/handle/123456789/2207
Carbajal-Valenzuela, I., Muñóz-Sanchez, A., Hernández-Hernández, J. Barona-Gómez, F., Truong, C. y Cibrián-Jaramillo, A. 2022. Microbial Diversity in Cultivated and Feral Vanilla Vanilla planifolia Orchids Affected by Stem and Rot Disease. Microb Ecol 84, 821–833. https://doi.org/10.1007/s00248-021-01876-8
Card, S., Johnson, L., Teasdale, S. y Caradus, J. 2016. Deciphering endophyte behaviour: the link between endophyte biology and efficacious biological control agents. FEMS Microbiol Ecol. 92, fiw114. https://doi.org/10.1093/femsec/fiw114
Chowdhary, K. y Kaushik, N. 2018. Biodiversity study and potential of fungal endophytes of peppermint and effect of their extract on chickpea rot pathogens. Arch. Phytopathol. Pflanzenschutz. 51, 139-155. https://doi.org/10.1080/03235408.2018.14 40707
De Almeida, A., Concas, J., Campos, M., Materatski, P., Varanda, C., Patanita, M., Murolo, S., Romanazzi, G. y Do Rosario, M. 2020. Endophytic Fungi as PotentialBiological Control Agents against Grapevine Trunk Diseases in Alentejo Region. Biology. 9(12), 420. https://doi.org/10.3390/biology9120420
De Silva, N., Brooks, S., Lumyong, S. y Hyde, K. 2019. Use of endophytes as biocontrol agents. Fungal Biol. Rev. 33, 133-148. https://doi.org/10.1016/j.fbr.2018.10.001
Eke, P., Adamou, S., Fokom, R., Dinango, V., Tsouh, P., Wakam, L., Nwaga, D. y Fekam, F. 2020. Arbuscular mycorrhizal fungi alter antifungal potential of lemon- grass essential oil against Fusarium solani, causing root rot in common bean (Phaseolus vulgaris L.). Heliyon. 6: e05737. https://doi.org/10.1016/j.heliyon.2020.e05737
Flanagan, N. y Mosquera-Espinosa, A. 2016. An integrated strategy for the conservation and sustainable use of native Vanilla species in Colombia. Lankesteriana. 16(2), 201–218. https://doi.org/10.15517/lank.v16i2.26007
Flores-de la Rosa, F., De Luna, E., Adame-García, J., Iglesias-Andreu, L. y Luna-Rodríguez, M. 2018. Phylogenetic position and nucleotide diversity of Fusarium oxysporum f. sp. vanillae worldwide based on translation elongation factor 1α sequences. Plant Pathol. 67(6): 1278 – 1285. https://doi.org/10.1111/ppa.12847
Food and Agriculture Organization Data (FAOSTAT). 2022. Vanilla Production. https://www.fao.org/faostat/en/#data
Gamboa, M. y Bayman, P. 2001. Communities of Endophytic Fungi in leaves of a Tropical Timber Tree (Guarea guidonia: Meliaceae). Biotropica. 33(2), 352-360. https://www.jstor.org/stable/266384
Gangadara, N., Saifulla, N., Najaraja, R. y Basavaraja, M. 2010. Biological control of Fusarium oxysporum f. sp. vanillae, the causal agent of stem rot of Vanilla in vitro. IJSN. 1(2), 259-261. ISSN 2229-6441
Ge, A., Liang, Z., Xiao, J., Zhang, Y., Zeng, Q., Xiong, C., Han, L.,Wang, J. y Zhang, L. 2021. Microbial assembly and association network in watermelon rhizosphere after soil fumigation for Fusariumwilt control. Agric. Ecosyst. Environ. 312, 107336.http://doi.org/10.1016/j.agee.2021.107336
Grisoni, M. y Nany, F. 2021. The beautiful hills: half a century of vanilla (Vanilla planifolia Jacks. ex Andrews) breeding in Madagascar. Genet Resour Crop Evol 68, 1691–1708. https://doi.org/10.1007/ s10722-021-01119-2
Hernández, J., Quintana, F. y Nava, H. 2018. Monitoring and analyzing environmental factors favoring outbreaks of Fusarium oxysporum f. Sp. vanillaein a vanilla shade house. Int. J. Agric. Biol. 11(1): 58 – 65. https://doi.org/10.25165/j.ijabe.20181101.2803
Hernández-Hernández, J. 2019. Vanilla Diseases. In: Havkin-Frenkel, D. y Belanger,F. (Eds.) Handbook of Vanilla Science and Technology, 2nd Edition. Wiley Blackwell. pp. 27-39
Hernández-Hernández, J. 2014. Técnicas implementadas para el cultivo de vainilla en México. In: Araya, C., Cordero, R., Paniagua, A., Azofeifa, J. (Eds.). I Seminario Internacional de Vainilla. Promoviendo la investigación, la extensión y la producción de vainilla en Mesoamérica. pp. 81-92
Horinouchi, H., Muslim, A. y Hyakumachi, M. 2010. Biocontrol of Fusarium wilt of spinach by the plant growth promoting fungus Fusarium equiseti GF183. J Plant Pathol. 92(1), 249-254. https://www.jstor.org/stable/41998793
Huang, L., Niu, Y., Su, L., Deng, H. y Lyu, H. 2020. The potential of endophytic fungi isolated from cucurbit plants for biocontrol of soilborne fungal diseases of cucumber. Microbiol Res. 231, 126396. https://doi.org/10.1016/j.micres.2019.126369
Jayasekhar, M., Manonmani, K., Justin, C. y Gailce, L. 2008. Development of integrated biocontrol strategy for the management of stem rot disease (Fusarium oxysporum f. sp. vanillae) of Vanilla. Agricultural Science Digest. 28(2), 109-111. https://arccjournals.com/journal/agricultural-science-digest/ARCC2554
Kadir, N., Naher, L., Kayat, F., Sidek, N., Zain, N. y Bakar, T. 2021. Morphological and molecular identification of Fusarium spp. and Colletotrichum spp. isolated from infected vanilla orchid. Malays. J. Microbiol. 17(1): 42-51. http://dx.doi.org/10.21161/mjm.200846
Foullaud, M., Verpoorte, R. y Kodja, H. 2015. Fungal endophytes of Vanilla across Réunion Island: isolation, distribution and biotransformation. BMC Plant Biol. 15,142. https://doi.org/10.1186/s12870-015-0522-5
Koyyappurath, S., Conéjero, G., Dijoux, J., LApeyre-Montés, F., Jade, K., Chiro- leu, F., Verdeil, J., Besse, P. y Grisoni, M. 2015. Differential responses of Vanilla Accessions to Root Rot and Colonization by Fusarium oxysporum f. sp. radicis. vanillae. Front. Plant Sci. 6:1125. https://doi.org/10.3389/fpls.2015.01125
Koyyappurath, S., Atuahiva, T., Le Guen, R., Batina, H., Le Squin, S., Gautheron, N., Edel Hermann, V., Peribe, J., Jahiel, M., Steinberg, C., Liew, E., Alabouvette, C., Besse, P., Dron, M., Sache, I., Laval, V. y Grisoni, M. 2016. Fusarium oxysporum f. sp. radicis-vanillae is the causal agent of root and stem rot of Vanilla. Plant Pathol. 65,612-625. https://doi.org/10.1111/ppa.12445
Latz, M., Jensen, B., Collinge, D. y Jørgensen, H. 2018. Endophytic fungi as biocontrol agents: Elucidating mechanisms in disease suppression. Plant Ecol Divers 11:555–567. https://doi.org/10.1080/17550874.2018.1534146
Li, H., Yan, C., Tang, Y., Ma, X., Chen, Y., Chen, S., Lin, M. y Liu, Z. 2020a. Endophytic bacterial and fungal microbiota in different cultivars of cassava (Manihot esculenta Crantz). J Microbiol. 58, 614–623. https://doi.org/10.1007/s12275-020-9565-x
Li, Z., Ma, L., Zhang, Y., Zhao, W., Zhao, B. y Zhang, J. 2020b. Effect of wheat cultivars with different resistance to Fusarium graminearum abundance and microbial community composition. Plant Soil. 448:383-397. https://doi.org/10.1007/s11104-020-04441-3
Li, W. y Liu, Q. 2019. Changes in fungal community and diversity in strawberry rhizosphere soil after 12 years in the greenhouse. Journal of Integrative Agriculture. 18(3): 677-687. https://doi.org/10.1016/S2095-3119(18)62003-9
Manosalva-Estepa, J. y Mosquera-Espinosa, A. 2014. Enfermedades fungosas en Uchuva (Physalis peruviana) y evaluación in vitro de hongos endófitos con actividad biocontroladora. Rev. Fito. Colomb. 38(1), 1-8
Marín-Montoya, M., Santa-Cardona, C. y Díez, M. 2012. Identification of the causal agent of vanilla basal stem rot in crops under greenhouse shed conditions from Colombia. Rev. Mex. Mic. 35, 23-34. https://www.scielo.org.mx/scielo.php?pi- d=S0187-31802012000100004&script=s-ci_abstract&tlng=en
Montes de Oca-Vásquez, G.M., Solano-Campos, F., Azofeifa- Bolaños, B., Paniagua-Vásquez, A., Vega- Baudrit, J., Ruiz-Navarro, A., López- Mondéjar, R. y Bastida, F. 2020. Microhabitat heterogeneity associated with Vanillaspp. and its influences on the microbial community of leaf litter and soil. Soil Ecol. Lett. 2, 195–208. https://doi.org/10.1007/s42832-020-0041-7
Mosquera-Espinosa, A., Bonilla-Monar, A., Flanagan, N. ,Rivas, Á., Sánchez, F., Chavarriaga, P., Bedoya, A. y Riascos-Ortiz, D. 2022. In Vitro Evaluation of the Development of Fusarium in Vanilla Accessions. Agronomy. 12, 2831. https://doi.org/10.3390/agronomy12112831
Mosquera-Espinosa, A., Bayman, P., Prado, G., Gómez-Carabali, A. y Tupac, J. 2013. The double life of Ceratoabasidium: orchid mycorryzal fungi and their potential for biocontrol of Rhizoctonia sonani sheath blight of rice. Mycologia. 105(1), 141–150. https://doi.org/10.3852/12-079
Muchem, M. y Yemata, G. 2022. Epidemio- logy and pathogenicity of vascular wilt of chickpea (Cicer arietinum L.) caused by Fusarium oxyporum f.sp. ciceris, and the host defense responses. S. Afr. J. Bot. 151:339-348. https://doi.org/10.1016/j.sajb.2022.10.008
Murphy, B., Jadwiszczak, M., Soldi, E. y Hodkindson, T. 2018. Endophytes from the crop wild relative Hordeum secalinum L. improve agronomic traits in unstressed and salt-stressed barley. 4, 1548195. https://doi.org/10.1080/23311932.2018.1549195
Nguyen, M., Yong, J., Sung, H. y Lee, J. 2020. Screening of Endophytic Fungal Isolates Against Raffaelea quercus- mongolicae Causing Oak Wilt Disease in Korea. Mycobiology. 48, 484-494. https:// doi.org/10.1080/12298093.2020.1830486
Novotná, A., Benítez, Á., Herrera, P., Cruz, D., Filipczyková, E. y Suárez, J. 2018. High diversity of root-associated fungi iso- lated from three epiphytic orchids in southern Ecuador. Mycoscience. 59:24-32. https://doi.org/10.1016/j.myc.2017.07.007
Olatunde, A., Mohammed, A., Ibrahim, M., Tajuddeen, N. y Shuaibu, M. 2022. Vainillin: A food additive with multiple biological activities. Eur. J. Med. Chem. 5: 10055. https://doi.org/10.1016/j.ejmcr.2022.100055
Olantinwo, R., So, C. y Eberhardt, T. 2019. Effect of Acaromyces Ingoldii Secondary Metabolites on the Growth of Brown-Rot (Gloeophyllum Trabeum) and White-Rot (Trametes Versicolor) Fungi. 47, 506-511. Mycobiology. https://doi.org/10.1080/12298093.2019.1686944
Ordoñez, N., Otero, T. y Díez, C. 2012. Hongos endófitos de orquídeas y su efecto sobre el crecimiento de Vanilla planifolia Andrews. Acta Agron. 61(3), 282-290. http://www.scielo. org.co/scielo.php?script=sci_art tex-t pid= S 0120- 28122012000300010
Peters, L., Prado, L., Silva, F., Souza, F. y Carvalho, C. 2020. Selection of endophytes as antagonists of Colletotrichum gloesporioides in acai palm. Biol. Control. 150:104350. https://doi.org/10.1016/j.biocontrol.2020.104350
Pinaria, A., Liew, E. y Burgess, L. 2010. Fusarium species associated with vanilla stem rot in Indonesia. Australas Pl. Pathol. 39, 176–183. https://doi.org/10.1071/AP09079
Pinaria, A., Laurence, M., Burgess, L. y Liew, E. 2015. Phylogeny and origin of Fusarium oxysporum f. sp. vanillae in Indonesia. Plant Pathol. 64, 1358-1465. https://doi.org/10.1111/ppa.12365
Porras-Alfaro, A. y Bayman, P. 2011. Hidden Fungi, Emergent Properties: Endophytes and Microbiomes. Annu Rev Phytopathol. 49, 291–315. https://doi.org/10.1146/annurev-phyto-080508-081831
Radjacommare, R., Venkatesan, S. y Samiyappan, R. 2010. Biological control of phytopathogenic fungi of vanilla through lytic action of Thichoderma species and Pseudomonas fluorescens. Arch. Phyto- pathol. Pflanzenschutz. 43(1), 1-17. https://doi.org/10.1080/03235400701650494
Ramírez-Mosqueda, M., Iglesias-Andreu, L., Luna-Rodríguez, M. y Castro-Luna, A. 2015.In vitro phytotoxicity of culture filtrates of Fusarium oxysporum f. sp. vanillae in Vanilla planifolia Jacks. Sci Hortic. 197, 573–578. https://doi.org/10.1016/j.scienta.2015.10.019
Ramírez-Mosqueda, M., Iglesias-Andreu, L., Noa-Carrazana, J. y Armas-Silva, A. 2018. Selection of Vanilla planifolia Jacks. ex Andrews genotypes resistant to Fusarium oxysporum f. sp. vanillae, by biotechnology.Rev.Agro.Prod.11(3),70-74. https://revista-agroproductividad.org/index.php/agroproductividad/article/view/219
Ramírez-Mosqueda, M., Iglesias-Andreu, L., Telxeira da Silva, J., Luna-Rodríguez, M., Noa-Carrazana, J., Bautista-Aguilar, J., Leyva-Ovalle, O. y Murguía-González, J. 2019. In vitro selection of vanilla plants resistant to Fusarium oxysporum f. sp. vanilla. Acta Physiol. Plant. 41, 40. https:// doi.org/10.1007/s11738-019-2832-y
Ramos-Quintana, F., Bautista-Hernández, A. y Sotelo-Nava, H. 2017. Relationship between temperature and relative humidity with the outbreak of the fungus Fusarium oxysporum f. sp. vanillae Rev. Mex. Cien Agr. 8(3), 713-720. https://doi.org/10.29312/remexca.v8i3.44
Ratankumar, A., Sharma, S., Behere, G., Akoijam, R., Singh, Y., Thokchom, S. y Nongtdu, E. 2022. First report of Fusarium oxysporum causing damping-off of tree bean (Parkia timoriana) seedlings in Northeastern India. Crop Protection. 155:105935. https://doi.org/10.1016/j.cropro.2022.105935
Rather, R., Srinivasan, V. y Anwar, M. 2018. Seasonal deviation effects foliar endophyte assemblage and diversity in Asparagus racemosus and Hemidesmus indicus. BMC Ecol 18, 52. https://doi.org/10.1186/ s12898-018-0211-y
Rodriguez, R., White Jr, J., Arnold, A. y Redman, A. 2009. Fungal endophytes: diversity and functional roles. New phytologist. 182(2), 314-330. https://doi.org/10.1111/j.1469-8137.2009.02773.x
Rojas, E., Jensen, B., Jorgensen, H., Latz, M., Esteban, P., Ding, Y. y Collinge, D. 2020a. Selection of fungal endophytes with biocontrol potential against Fusarium head blight in wheat. Biol Control. 144, 104-222. https://doi.org/10.1016/j.biocontrol.2020.104222
Rojas, E., Sapkota, R., Jensen, B., Jorgensen, H., Henriksson, T., Jorgensen, L., Nicolaisen, M. y Collinge, D. 2020b. Fusarium Head Blight Modifies Fungal Endophytic Communities During In- fection of Wheat Spikes. Microb. Ecol. 79, 397-408. https://doi.org/10.1007/s00248-019-01426-3
Romero-Cortes, T., Pérez, V., López, P., Rodríguez-Jimenes, G., Robles-Olvera, V. y Aparicio, J. 2019. Antifungal activity of vanilla juice and vanillin against Alterna- ria alternata. CYTA–Journal of Food. 17, (1): 375–383. https://doi.org/10.1080/19476337.2019.1586776
Sandheep, A., Asok, A. y Jisha, M. 2012. Biocontrol of Fusarium wilt of vanilla (Vanilla planifolia) using combined inoculation of Trichoderma sp. and Pseudomonas sp. Int. J. Pharma Bio Sci. 3(3), 706 – 716. https://doi.org/10.3923/pjbs.2013.580.584
Sarsaiya, S., Shi, J. y Chen, J. 2019. A comprehensive review on fungal endophytes and its dynamics on Orchidaceae plants: current research, challenges, and future possibilities. Bioengineered. 10(1), 316-334. https://doi.org/10.1080/21655979.2019.1644854
Scott, M., Rani, M., Samsatly, J., Charron,J. y Jabaji, S. 2018. Endophytes of industrial hemp (Cannabis sativa L.) cultivars: identification of culturable bacteria and fungi in leaves, petioles, and seeds. Can J Microbiol. 64(10):664-680. https://doi.org/10.1139/cjm-2018-0108
Shahrtash, M. y Brown, S. 2023. Interactions between fungal endophytes and pathogens isolated from the invasive plant kudzu (Pueraria montana var. lobata). Arch. Phytopathol. Pflanzenschutz. 56, 87-107. https://doi.org/10.1080/03235408.2023.2178055
Sharma, P. 2022. Biocontrol strategies retrospect and prospects. Indian Phytopathol. https://doi.org/10.1007/s42360-023-00601-4
Sharma, S., Gupta, S., Dhar, M. y Kaul, S. 2018. Diversity and Bioactive Potential of Culturable Fungal Endophytes of Medicinal Shrub Berberis aristata DC.: A First Report. Mycobiology. 46, 370-381.https://doi.org/1 0.1080/12298093.2018.1538068
Silva, R., Neto, W., Oliveira, R., Bezerra, J., Bezerra, J., De Lima, V., Vieira, L., Tobosa, J., Souza-Motta, C. y Silva, G. 2023. Effect of climate and phenological stage on fungal endophytes community on Sorghum bicolor leaves. Mycol. Prog. 22,19.
Solano-De la Cruz, M.T., Adame-García, J., Gregorio-Jorge, J., Jiménez-Jacinto, V., Vega-Alvarado, L., Iglesias-Andreu, L., Escobar-Hernández, E. y Luna-Rodríguez, M. 2019. Functional categorization of de novo transcriptome assembly of Vanilla planifolia Jacks. potentially points to a translational regulation during early stages of infection by Fusarium oxysporum f. sp. vanillae. BMC Genomics. 20, 826. https://doi.org/10.1186/s12864-019-6229-5
Soleha, S., Muslim, A., Suwandi, S., Kadir, S. y Pratama, R. 2022. The identification and pathogenicity of Fusarium oxysporum causing acacia seedling wilt disease. J. For. Res. 33, 711–719. https://doi.org/10.1007/s11676-021-01355-3
Soto-Arenas, M. y Dressler, R. 2004. Vanilla. In: Hammel, B., Grayum, M., Herrera C., Zamora, N. (Eds.) Manual de Plantas de Costa Rica, III, Monocotiledónea (Orchidaceae-Zingiberaceae). Missouri Botanical Garden, -INBio-Museo Nacional de Costa Rica. pp. 383-387
Srivastava, S., Kadooka, C. y Uchida, J. 2018. Fusarium species as pathogen on orchids. Microbiol Res. 207, 188-195. https://doi.org/10.1016/j.mi-cres.2017.12.002
Suryanarayanan, T., Rajulu, G. y Vidal, S. 2016. Biological control through fungal endophytes: Gaps in knowledge hindering success. Curr. Biotecnol. 5(3), 1-14. https://doi.org/10.2174/2211550105666160504130322
Talapatra, K., Roy, A., Saha, A. y Das, P. 2017. In vitro antagonistic activity of a root endophytic fungus towards plant pathogenic fungi. J. appl. Biol. Biotech- nol. 5(2), 68-71. https://doi.org/10.7324/JABB.2017.50210
Talukdar, R. y Tayung, K. 2021. Endophytic fungal assemblages of Zanthoxylum oxyphyllum and their antimicrobial potential. Plant Science Today. 8(1):132–139. hhttps://doi.org/10.14719/pst.2021.8.1.979
Villamizar-Gallardo, R., Ortiz-Rodríguez, O. y Escobar, J. 2017. Symbiotic and endophytic fungi as biocontrols against cocoa (Theobroma cacao L.) phytopathogens. Summa Phytopathol. 43(2), 87-93. https://doi.org/10.1590/0100-5405/2175
Villavicencio-Vásquez, M., Espinosa- Lozano, R., Pérez-Martínez, S. y Sosa del Castillo, D. 2018. Foliar endophyte fungi as candidate for biocontrol against Moniliophthora spp. of Theobroma cacao (Malvaceae) in Ecuador. Acta. Biol. Col. 23(3), 235-241. https://doi.org/10.15446/abc.v23n3.69455
White, J., Torres, M., Sullivan, R., Jabbour, R., Chen, Q., Tadych, M., Irizarry, I., Bergen, M., Havkin-Frenkel, D. y Belanger, F. 2014. Microscopy Research and Technique: Ocurrence of Bacillus amyloliquefaciens as a Systemic En- dophyte of Vanilla Orchids. Microsc. Res. Techniq. 77(11), 874-885. https://doi.org/10.1002/jemt.22410
Wilson, D. 1995. Endophyte: The Evolution of a Term, and Clarification of Its Use and Definition. Oikos. 73(2), 274-276. https://doi.org/10.2307/3545919
Wu, Z., Su, Q., Cui, Y. He, H., Wnag, J., Zhang, Y., Zhao, Y., Abul, H., Yang, Y. y Long, Y, 2020. Temporal and spatial pattern of endophytic fungi diversity of Camellia sinensis (cv. Shu Cha Zao). BMC Microbiol 20, 270. https://doi.org/10.1186/s12866-020-01941-1
Wu, AL., Jiao, XY., Fan, FF., Wang, JS., Guo, J., Dong, EW., Wang, LG. y Shen, XM. 2019. Effect of continuous sorghum cropping on the rhizosphere microbialcommunityand the role of Bacillus amyloliquefaciens in altering the microbial composition. Plant Growth Regul. 89, 299–308.https://doi.org/10.1007/s10725-019-00533-y
Xiong, W., Li, R., Ren, Y., Liu, C., Zhao, Q., Wu, H., Jousset, A. y Shen, Q. 2017. Distinct roles for soil fungal and bacterial communities associated with the suppres- sion of vanilla Fusarium wilt disease. Soil Biol. Biochem. 107, 198–207. https://doi.org/10.1016/j.soilbio.2017.01.010
Xiong, W., Zhao, Q., Xue, C., Xun, W., Zhao, J., Wu, H., Li, R. y Shen, Q. 2016. Comparison of Fungal Community in Black Pepper-Vanilla and Vanilla Monoculture Systems Associated with Vanilla Fusarium Wilt Disease. Front. Microbiol. 7:117. http//doi.org/10.3389/fmicb.2016.00117
Xiong, W., Zhao, Q., Zhao, J., Xun, W., Li, R., Zhang, R. y Shen, Q. 2015. Different Continuous Cropping Spans Significantly Affect Microbial Commu- nity Membership and Structure in a Vanilla-Grown Soil as Revealed by Deep Pyrosequencing. Microb. Ecol. 70(1): 209–218. https://doi.org/10.1007/s00248-014-0516-0
Yang, J., Ren, X., Liu, M., Fan, P., Ruan,P., Zhao, Y., Wang, B. y Li, R. 2022. Suppressing soil-borne Fusarium pathogens of bananas by planting different cultivars of pineapples, with comparisons of the resulting bacterial and fungal communities. Appl. Soil. Ecol. 169:104211. https://doi.org/10.1016/j.apsoil.2021.104211
Yu, J., Wu, Y., He, Z., Li, M., Zhu, K. y Gao, B. 2018. Diversity and antifungal activity of endophytic fungi associated with Camellia oleifera. Mycobiology. 46, 85-91. https://doi.org/10.1080/12298093.2018.1454008
Zhang, Y., Tian, C., Xiao, J., Wei, L., Tian, Y. y Liang, Z. 2020. Soil inoculation of Trichoderma asperellum M45a regulates rhizosphere microbes and triggers watermelon resistance to Fusarium wilt. AMB Expr. 10, 189.https://doi.org/10.1186/s13568-020-01126-z
Zhang, Y., Yu, X., Zhang, W., Lang, D., Zhang, X., Cui, G. y Zhang, X. 2019. Interactions between Endophytes and Plants: Beneficial Effect of Endophytes to Ameliorate Biotic and Abiotic Stresses in Plants. J. Plant Biol. 62, 1–13. https://doi.org/10.1007/s12374-018-0274-5
Zhao, Q., Wang, H. y Wang, H. 2012. Effects of planting period on vanilla physiological indices and rhizosphere soil microbial community structure. Chin J Trop Crop. 33:1562–1567
Notas

